




Next: 2.1 Atomare Einheiten
Up: Zusammenfassung Atomphysik
Previous: 1.4 Die Experimente von
Inhalt
Index
Grundlagen:
- Linienspektren der Atome
 Beobachtungen von
Kirchhoff (Absorptionslinien, Emissionslinien, beide die gleiche
Wellenlnge, fr jedes Element charakteristisch, nur diskrete
Linein mglich...)
Beobachtungen von
Kirchhoff (Absorptionslinien, Emissionslinien, beide die gleiche
Wellenlnge, fr jedes Element charakteristisch, nur diskrete
Linein mglich...)
- Balmerformel:
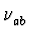 = R
= R
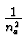 -
- 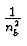
 wobei na, nb ganzzahlig sind,
R = 109677.851/cm: Rydbergkonstante
wobei na, nb ganzzahlig sind,
R = 109677.851/cm: Rydbergkonstante
- Ritz'sches Kombinationsprinzip: Existieren zwei Linien
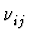 und
und 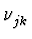 , so existieren auch die entsprechenden
Linearkombinationen
, so existieren auch die entsprechenden
Linearkombinationen
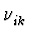 =
= 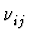 +
+ 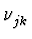
Annahmen und Postulate von Bohr:
- Elektronen bewegen sich auf Kreisbahnen
- Nur bestimmte Bahnen sind erlaubt (stationre Zustnde)
- Elektronen in einem stationren Zustand strahlen nicht
- EM-Abstrahlung geschieht durch bergnge zwischen stationren
Zustnden.
- Jeder bergang entspricht einem Photon, so daá fr die Bahnen
gilt:
h
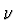 = Eb - Ea (Bohr'sche Frequenzrelation)
= Eb - Ea (Bohr'sche Frequenzrelation)
- Der Drehimpuls des Elektrons ist gequantelt, es gilt:
L = n
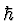
Aus
ergeben sich die Werte fr v und r und daraus dann das Energieschema
fr Wasserstoff
En = - 13, 6eVZ2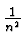 wo n die
Hauptquantenzahl ist. Den Radius des Elektrons im Grundzustand nennt
man Bohrradius, er betrgt etwa
a0 = 5, 29 . 10-11m.
wo n die
Hauptquantenzahl ist. Den Radius des Elektrons im Grundzustand nennt
man Bohrradius, er betrgt etwa
a0 = 5, 29 . 10-11m.
Verbesserungen des ursprnglichen Modells:
- Kernmitbewegung (ersetzen der elektronenmasse durch die
reduzierte Masse, dadurch ndert sich die Rydbergkonstante!)
- Elliptische Bahnen
Hiermit liefert das Bohrmodell gute Ergebnisse fr leichte Kerne bis
Z 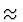 20.
20.
Grenzen des Bohrmodells:
- Willkrliche Annahmen (Kreisbahnen)
- Keine Mglichkeit zur Bestimmung von bergangsraten
- Keine Verallgemeinerung auf Mehrelektronenatome mglich
- Keine Behandlung ungebundener Systeme





Next: 2.1 Atomare Einheiten
Up: Zusammenfassung Atomphysik
Previous: 1.4 Die Experimente von
Inhalt
Index
Alexander Wagner
2000-04-15
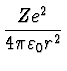 =
= ![]() wo n die
Hauptquantenzahl ist. Den Radius des Elektrons im Grundzustand nennt
man Bohrradius, er betrgt etwa
a0 = 5, 29 . 10-11m.
wo n die
Hauptquantenzahl ist. Den Radius des Elektrons im Grundzustand nennt
man Bohrradius, er betrgt etwa
a0 = 5, 29 . 10-11m.
![]() 20.
20.