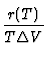
|
(148) |
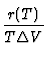
|
(148) |
Herleitung aus den Gleichgewichtsbedingungen d.h. Chemische Potentiale zwischen den Phasen gleich (= Gleichheit der freien Enthalpie G bei konstanter Stoffmenge). Z. B. fr die Dampfdruckkurve Gfl(p, T) = Ggas(p, T) aufgelst nach p = p(T). Alternativ gewinnt man die Dampfdruckkurve, wenn man in G eine Differentialgleichung aufstellt:
|
G(p + dp, T + dT) = G(p, T) + |
(149) |
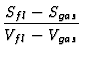
|
(150) |
Bemerkung: Da
G = H - TS folgt hier mit
![]() G = 0 und
T
G = 0 und
T![]() S = r(T) die Interpretation der Enthalpie H als
latente Wrme:
S = r(T) die Interpretation der Enthalpie H als
latente Wrme:
![]() H = r(T)
H = r(T)
Fhrt man vereinfachend ein
![]() V = Vgas (d. h.
Vfl
V = Vgas (d. h.
Vfl ![]() Vgas) und nimmt fr das Gas die allgemeine Gasgleichung an, so
sieht man
Vgas) und nimmt fr das Gas die allgemeine Gasgleichung an, so
sieht man
|
p = p0e+ |
(151) |
==> Hier weiter <==