



Next: 7.3 Joule-Thompson-Prozess
Up: 7. Phasenbergnge
Previous: 7.1 Gibbs'sche Phasenregel
Inhalt
Index
Van-der-Waals-Gleichung:
bergang vom realen Gas zum idealen Gas jenseits der kritischen
Parameter
Tk, pk, Vk. Diese ergeben sich aus der Forderung, daá
bei den kritischen Parametern die erste und die zweite Ableitung
verschwinden (Sattelpunkt). Man findet:
| Vk |
= |
3b |
(129) |
| pk |
= |
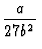 |
(130) |
| Tk |
= |
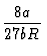 |
(131) |
Miát man in Einheiten der kritischen Parameter erhlt man durch
Einsetzen die reduzierte Zustandsgleichung. Vorteil:
Verschiedene Substanzen zeigen bei groáe Unterschiede im Verhalten.
ber die reduzierte Zustandsgleichung wird ein Vergleich der
Substanzen mglich, d.h. man findet gleiches Verhalten, wenn
reduzierter Druck und Volumen bereinstimmen: Gesetz
korrespondierender Zustnde.
Gebiet des Phasenbergangs (unterhalb der kritischen Parameter):
- Isotherme ist in einem Bereich mechanisch instabil:
Hier mchte sich das Gas selbst komprimieren
unphysikalisch Ersetzung der Isothermen durch die
Maxwellgerade
- Die Maxwellgerade liegt so, daá die Flchen zwischen
der Geraden und der Isotherme gleich sind.
- Durchlaufen der Isothermen ist mglich in weiten Bereichen
auch im unphysikalischen Gebiet mglich, wenn man vorsichtig
arbeitet (keine Erschtterungen, keine Kondensationskeime)
- bersttigter Dampf: Durchlaufen der des rechten
Teils der unphysikalischen Isotherme. Wichtige Anwendung:
Nebelkammer
- Siedeverzug: Durchlaufen des linken Teils der
unphysikalischen Isothermen. Wichtige Anwendung:
Blasenkammer
- Der unphysikalische Bereich ist kein
Gleichgewichtszustand.
- Gleichgewicht herrscht auf der Maxwellgeraden, wo immer mehr
Flssigkeit kondensiert/verdampft (je nach Durchlaufsinn).
Daraus kann man die Lage der Maxwellgeraden herleiten.




Next: 7.3 Joule-Thompson-Prozess
Up: 7. Phasenbergnge
Previous: 7.1 Gibbs'sche Phasenregel
Inhalt
Index
Alexander Wagner
2000-04-15