



Next: 6.9 Thermodynamische Potentiale und
Up: 6. Thermodynamische Potentiale und
Previous: 6.7 Freie Energie und
Inhalt
Index
Thermische Zustandsgleichung
-
v =
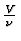 : Molvolumen
: Molvolumen
- b: Kovolumen
-
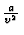 : Binnendruck
: Binnendruck
- a, b positive, substanzspezifische Konstanten
- Beschreibt Verhalten realer Gase
- Geht fr verdnnte Gase in die ideale Gasgleichung ber, weil
a, b dann vernachlssigbar sind
Aus der Definition der Wrmekapazitt und der
Zustandsgleichung volumenunabhngige
Molwrme:
cV = 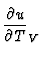
|
(115) |
und damit
du = cV(T)dT + 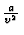 dv, woraus man durch
Integration die Molenergie erhlt. Ist cV(T) explizit
bekannt ergibt sich die kalorische Zustandsgleichung. Fr
cV = const. lautet sie:
dv, woraus man durch
Integration die Molenergie erhlt. Ist cV(T) explizit
bekannt ergibt sich die kalorische Zustandsgleichung. Fr
cV = const. lautet sie:
u(T, v) = cVT - 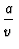 + const.
+ const.
|
(116) |
Im Gegensatz zum idealen Gas vom Molvolumen abhngig, die
energievermindernde Anziehung der Teilchen wird mit wachsendem Volumen
schwcher.
Alexander Wagner
2000-04-15