Die innere Energie ist eine extensive Zustandsgrpe iene
homogene Funktion (skaliert bei Systemvergráerung um
![]() linear mit
linear mit ![]() ). Mit Eulers Theorem
). Mit Eulers Theorem
U(S, V, N1,..., Nn) = 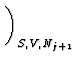 Nj Nj
|
(107) |
|
G = U - TS + pV = |
(108) |
chemisches Potential = freie Enthalpie pro Molekl:
|
|
(109) |
Aus einem Vergleich des totalen Differentials der inneren Energie
|
dU = TdS + SdT - pdV - Vdp + |
(110) |
gibt die Gibbs-Duhem-Relation
|
SdT - Vdp + |
(111) |