10cmBei Annherung eines homogenen Systems an den absoluten Nullpunkt nimmt die Entropie S0 im Gleichgewicht einen konstanten Wert unabhngig von den thermodynamischen Parametern an. Dieser Wert wird gleich null gesetzt, also S0 = 0 fr T = 0. (Nach Planck)
Statistisch:
S = kln(![]() (E, x1,..., xn)). Bei Verringerung
der Energie nhert sich das System seinem
Grundzustand, welcher nicht entartet ist. Hier gilt
(E, x1,..., xn)). Bei Verringerung
der Energie nhert sich das System seinem
Grundzustand, welcher nicht entartet ist. Hier gilt
![]() (EG) = 1 und damit S = 0. Da
(EG) = 1 und damit S = 0. Da
![]()
![]() (E - EG)f findet
man als Verhalten der Entropie bei Annherung an den
absoluten Nullpunkt
(E - EG)f findet
man als Verhalten der Entropie bei Annherung an den
absoluten Nullpunkt
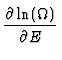
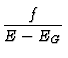
|
(56) |
Betrachte einen Kreisprozess, bei dem die tiefere Temperatur 0 ist. Nach dem 2. Hauptsatz gilt dann
|
|
(57) |
Der absolute Nullpunkt lát sich mit reversiblen isothermen Prozessen nicht erreichen!